I supercondensatori (di seguito SC) sono governati dalle stesse equazioni fondamentali dei condensatori convenzionali ma utilizzano elettrodi con superfici maggiori e un dielettrico più sottile per raggiungere capacità di gran lunga maggiori. Effettuiamo quindi un breve excursus delle caratteristiche dei condensatori per comprendere e apprezzare le idee alla base dei SC.
1 Condensatori
Un condensatore è un dispositivo formato da due superfici conduttrici tenute vicine (elettrodi) e a cui viene applicata una differenza di potenziale (d.d.p.) con la quale si portano delle cariche su una delle due superfici, per cui sull’altra sono trasportate cariche di segno opposto. Le cariche sono tenute separate da un dielettrico, producendo così un campo elettrico che permette al condensatore di immagazzinare energia.
La capacità C di un conduttore è definita come il rapporto tra la carica (positiva) immagazzinata Q e la tensione applicata V:
![]()
Per un condensatore convenzionale, C è direttamente proporzionale all’area A della superficie di ciascun elettrodo e inversamente proporzionale alla distanza d tra gli elettrodi:
![]()
dove ε0 è la costante dielettrica (o permittività) del vuoto e εr è la costante dielettrica relativa del mezzo isolante posto tra i due elettrodi.
Le due proprietà principali di un condensatore sono la sua energia specifica Esp e la potenza specifica Psp. Per entrambe le quantità specifiche possono essere calcolate come per unità di massa o per unità di volume. L’energia E immagazzinata in un condensatore è direttamente proporzionale alla sua capacità e al quadrato della tensione applicata:
![]()
In generale, la potenza P è l’energia erogata per unità di tempo. Per determinare P per un condensatore, bisogna considerare il dispositivo come in generale facente parte di un circuito dove è collegato in serie ad esso una resistenza esterna di carico R. Le componenti interne di un condensatore (per esempio i collettori di corrente, gli elettrodi e il materiale dielettrico) contribuiscono anch’essi alla resistenza, che è misurata nel suo complesso da una quantità nota come resistenza equivalente in serie (Equivalent Series Resistance – ESR). La tensione durante lo scaricamento è determinata da queste resistenze. Quando misurata in una condizione detta impedenza di accoppiamento (R=ESR), la potenza massima Pmax di un condensatore è data da:

Questa relazione mostra come la ESR può limitare la potenza massima di un condensatore; cominciamo a vedere quindi cosa cambia nel passaggio ai supercondensatori.
I SC sono governati dagli stessi principi di base dei condensatori convenzionali, la differenza è che incorporano elettrodi con una superficie avente area A molto maggiore e un dielettrico molto più sottile che fa calare la distanza D tra gli elettrodi. Di conseguenza, dalle equazioni (2) e (3) deriva un incremento sia della capacità (raggiungendo decine o centinaia di Fg-1) sia dell’energia. I SC sono caratterizzati da una geometria degli elettrodi tutt’altro che regolare; tuttavia, in prima approssimazione, rimane comunque valida la dipendenza (anche se non lineare) del valore di capacità dall’area degli elettrodi, dalla costante dielettrica e dalla distanza fra le cariche, in maniera diretta per la prima e la seconda, in maniera inversa per la terza.
Un confronto tra i diversi tipi di dispositivi per l’accumulo energetico può essere visualizzato schematicamente utilizzando il diagramma di Ragone: esso riporta la potenza specifica Psp in funzione dell’energia specifica Esp. Nella Figura 1 si vede che i condensatori convenzionali hanno una densità di potenza relativamente alta ma una densità di energia relativamente bassa se comparati con le batterie elettrochimiche e con le celle a combustibile, mentre i SC occupano una regione intermedia tra i condensatori convenzionali e le batterie. I più grandi SC, attualmente, possono arrivare a valori di capacità superiore ai 5000 F mentre la più alta densità di energia raggiunta è di 30 Whkg-1. I valori tipici dell’ESR per gli attuali SC in commercio sono compresi fra 80 e 20 mΩ per capacità comprese tra 650 e 5000 F.
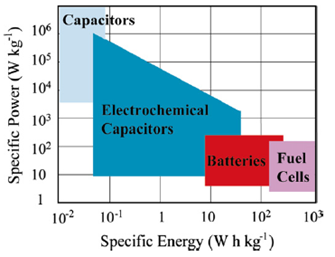
Figura 1: Ragone plot dei principali dispositivi di accumulo energetico [28].
2 Tipologie di supercondensatori
Prima dei SC si ottennero i condensatori elettrolitici, essi sono fogli di alluminio in mezzo ai quali, oltre a un liquido elettrolitico, viene inserita una sottile pellicola (spessa alcuni micrometri) di ossido di alluminio che funge da dielettrico.
I veri e propri supercondensatori elettrochimici (detti anche ultracondensatori) possono essere suddivisi in condensatori a doppio strato elettrico (detti EDLC, cioè electrical double-layer capacitor), pseudo-condensatori e condensatori di tipo ibrido (Figura 2); essi sono rispettivamente non-faradici, faradici e una combinazione dei due (per processo faradico si intende uno in cui avvengono reazioni con trasferimento di cariche tra elettrodi ed elettrolita, come nelle reazioni redox). Trattiamo separatamente tali tre tipi di SC.
3 EDLC
Il primo condensatore a doppio strato elettrico venne brevettato nel 1957 (un cilindretto riempito di un elettrolita in cui erano immersi due elettrodi piani coperti di carbone poroso); il primo vero prototipo di EDLC fu sviluppato nel 1970 in Russia da N. Lidorenko e A. Ivanov. Il primo EDLC commerciabile fu del 1970 e prodotto dalla NEC sotto il nome “supercondensatore” e in generale tuttora gli EDLC sono il principale tipo di SC.
Figura 2: Tassonomia dei supercondensatori [12].
Un EDLC si ottiene a partire da un condensatore sostituendo il dielettrico con una soluzione elettrolitica e ponendo sugli elettrodi metallici uno strato di carbone poroso reso conduttore (carbone attivo o solo AC, activated carbon). La superficie A da considerare diventa quella del carbone, resa molto ampia grazie a tutte le rientranze e insenature, e quella dello strato di ioni adsorbito su di esso, mentre la distanza D è molto minore perché va a coincidere con quella intermolecolare tra gli ioni dell’elettrolita e gli atomi di carbonio (Figura 3). Ognuno dei due elettrodi funge quindi da una delle due superfici di due condensatori in serie. I due elettrodi sono separati da una membrana, il setto separatore (detto anche solo separatore), il quale permette la mobilità degli ioni elettrolitici e allo stesso tempo impedisce meccanicamente che si abbia un cortocircuito tra il carbone conduttivo e la superficie metallica di elettrodi diversi.
Come nei condensatori convenzionali, gli EDLC immagazzinano le cariche elettrostaticamente (o detto in altro modo non-faradicamente) e non c’è al-cun trasferimento di carica tra elettrodo e elettrolita (una conseguenza è che la formazione del doppio strato avviene nell’ordine di 10 8 s). In ogni caso, gli elettrodi sono ingegnerizzati per prevenire la ricombinazione degli ioni. Siccome non ci sono reazioni faradiche, l’accumulo di cariche è altamente reversibile, permettendo ad esse una stabilità ciclica molto alta: gli EDLC possono essere stabili per 106 cicli, mentre le batterie elettrochimiche sono generalmente limitate a circa 103 cicli. Le prestazioni e i costi di un EDLC
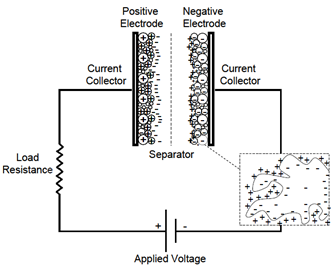
Figura 3: Schema di un EDLC [12].
Come nei condensatori convenzionali, gli EDLC immagazzinano le cariche elettrostaticamente (o detto in altro modo non-faradicamente) e non c’è alcun trasferimento di carica tra elettrodo ed elettrolita (una conseguenza è che la formazione del doppio strato avviene nell’ordine di 10-8 s). In ogni caso, gli elettrodi sono ingegnerizzati per prevenire la ricombinazione degli ioni. Siccome non ci sono reazioni faradiche, l’accumulo di cariche è altamente reversibile, permettendo ad esse una stabilità ciclica molto alta: gli EDLC possono essere stabili per 106 cicli, mentre le batterie elettrochimiche sono generalmente limitate a circa 103 cicli.
Le prestazioni e i costi di un EDLC dipendono da quelli dei suoi componenti nelle proporzioni mostrate in Figura 4 (Copyright C 2014 IDTechEx).
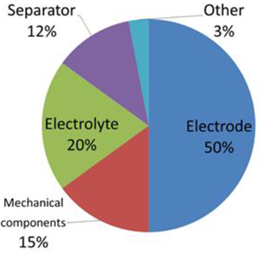
Figura 4: Diagramma a torta della percentuale delle performance e dei costi delle componenti di un EDLC.
3.1 Elettrodi
Come anticipato, gli elettrodi presentano uno strato di materiale poroso che può essere realizzato in più modi, in particolare descriviamo vari sistemi con cui si può realizzare un elettrodo al carbonio e con il grafene.
Prima di iniziare, facciamo notare che ci si potrebbe aspettare che la capacità specifica sia direttamente proporzionale all’area della superficie dell’elettrodo al carbonio, ma non è sempre questo il caso. Spesso, un tipo di carbonio con una superficie di area minore avrà una capacità specifica maggiore di quello con una superficie di area maggiore. Ciò succede perché la capacità reale del doppio strato varia in base al processo usato per preparare il carbonio. Il trattamento con cui si ha carbone attivo, per esempio, influenza la struttura porosa della superficie dell’elettrodo ed anche l’accessibilità dei suoi pori all’elettrolita è importante. A tal proposito ricordiamo che la conduttività è inversamente proporzionale alle dimensioni delle particelle, così che un materiale con superficie ad area maggiore e che quindi è fatto di particelle più piccole sviluppa un aumento della resistenza (faremo ulteriori approfondimenti in seguito).
Carbone attivo
Il carbone attivo (Activated Carbon – AC) deriva da un precursore organico ricco di carbonio tramite una carbonizzazione (trattamento con calore) in atmosfera inerte e poi da un processo di attivazione che crea la rete porosa nel volume del materiale al carbonio (Figura 5). Tale attivazione è realizzata da un’ossidazione parziale e controllata del precursore dell’AC.
Figura 5: Una particella di carbone attivo vista al microscopio elettronico.
I SC basati sul carbone attivo sono la tecnologia più sviluppata grazie al loro basso costo, grande capacità e lunga stabilità ciclica. In particolare, a proposito del basso costo, riveliamo che un AC si può produrre per carbonizzazione di gusci di noce, torba, legno, lignite e carbone.
I carboni attivi utilizzano una complessa struttura porosa composta di pori di diverse dimensioni detti micropori (diametro < 20 Å), mesopori (diametro 20 – 50 Å) e macropori (diametro > 50 Å). Non tutte le superfici ad area ampia (fatta di micropori) contribuiscono alla capacità del dispositivo perché gli ioni solvatati di un elettrolita, spesso troppo larghi, hanno difficoltà ad entrare nei pori più piccoli. Viceversa, pori più grandi non implicano sempre capacità maggiori, infatti le prestazioni migliori si ottengono con dimensioni dei pori simili a quella degli ioni solvatati dell’elettrolita usato, così che questi per entrare nei pori debbano deformare e a limite ridimensionare il guscio di solvatazione che si forma intorno ad essi, per cui la carica agli elettrodi sarà maggiore (Figura 6).
Figura 6: Schema dell’adsorbimento di ioni in micropori (a), mesopori (b) e macropori (c) di carbonio per una soluzione elettrolitica.
Simulazioni computazionali (metodo Hartree-Fock e con la Teoria del Funzionale Densità) offrono una spiegazione ancora più dettagliata del perché la capacità di un elettrodo al carbonio sia massima con pori di dimensioni poco inferiore a quella degli ioni: la densità di carica superficiale che si genera quando gli ioni entrano in contatto con l’elettrodo implica un potenziale che causa un’elongazione dei legami covalenti C-C, permettendo un impacchettamento più intenso degli ioni nella struttura porosa; è come dire che la capacità non è allora determinata solo dalla geometria dei pori ma anche dell’ingresso in sé degli ioni in essi. Un modo per testare se viene utilizzato tutto il carbone attivo di un elettrodo è verificare se la capacità specifica resta invariata cambiando la massa dell’elettrodo. In ogni caso, si usa correlare i pori più larghi con una potenza specifica maggiore e i pori più stretti con una energia specifica maggiore. Costruttivamente, per ovviare alla considerevole resistenza di contatto tra collettore e grani della polvere di carbone e fra i grani stessi, il materiale attivo è generalmente pressato e stabilizzato con un di un legante polimerico su un foglio di alluminio che funge contemporaneamente da collettore elettrico e da supporto meccanico alla polvere di carbonio (Figura 7).
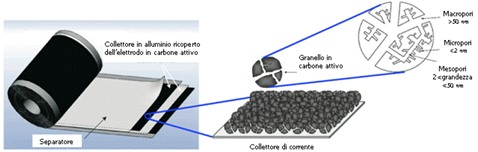
Figura 7: Struttura costruttiva di un tipico supercondensatore EDLC [70], [69].
Lo stesso tipo di carbone può essere aggiunto in modo diverso ai due elettrodi, realizzando i cosiddetti EDLC Asimmetrici (AEDLC). Tali dispositivi riescono generalmente a raggiungere tensioni operative maggiori poiché sfruttano l’intera finestra elettrochimica di stabilità (Electrochemical Stability Window – ESW) della soluzione elettrolitica impiegata. Infatti, la soluzione elettrolitica può avere tensioni di rottura asimmetriche (generalmente la tensione di rottura verso potenziali negativi è maggiore rispetto a quella verso potenziali positivi, e.s.: -1.7V e +1.3V).
Con EDLC simmetrici (i due elettrodi hanno lo stesso carico di carbonio e circa la stessa capacità specifica) la tensione viene applicata simmetricamente agli elettrodi e il limite sarà definito dal doppio della tensione di rottura più bassa in modulo; ad esempio per tensioni di rottura -1.7V e +1.3V, la tensione operativa in EDLC simmetrici può raggiungere 2.6V. In un AEDLC, variando il rapporto delle masse del materiale attivo due elettrodi, si riescono a sfruttare appieno i potenziali asimmetrici raggiungendo una tensione operativa di 3.0V nell’esempio precedente (Figura 8).
Il rapporto fra le masse da impiegare in funzione delle caratteristiche dell’elettrodo (Capacità specifica positiva C+ e negativa C–) e della soluzione elettrolitica (tensione di rottura positiva ΔV+ e negativa ΔV–) può essere definito dalla seguente equazione:
![]()
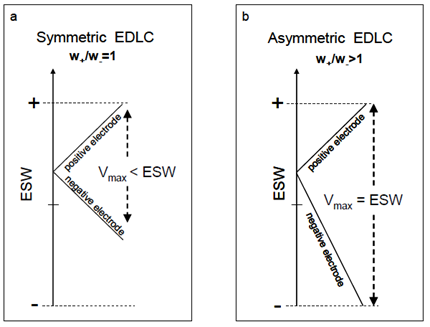
Figura 8 Schema dell’escursione del potenziale nella configurazione simmetrica (a) e asimmetrica (b).
Aerogel a carbonio
Gli aerogel a carbonio sono formati da una rete continua di nanoparticelle conduttive di carbonio intervallate da mesopori in un gel. A causa di questa struttura continua e della loro abilità a legarsi chimicamente con i collettori di corrente, gli aerogel non richiedono l’applicazione di agenti di legame adesivi addizionali. Come elettrodi senza leganti, gli aerogel hanno mostrato di avere una minore ESR rispetto al carbone attivo, hanno anche un’ampia area e buona conducibilità.
La dimensione delle particelle è controllata del processo di preparazione e in particolare particelle più piccole implicano una maggiore area accessibile ai pori.
Nanotubi di carbonio
I nanotubi di carbonio sono dei filamenti di carbonio, sia a strato singolo che a multi-strato, dal diametro che va da 1 a 50 nm. Gli elettrodi fatti di questo materiale sono fabbricati come un tappetino di nanotubi con una rete di mesopori aperta e accessibile: questa struttura unica è rappresentata in Figura 9.
Figura 9 Un “tappetino” di nanotubi di carbonio, lunghi circa 300 m, allineati verticalmente su un substrato metallico
A differenza degli altri elettrodi basati sul carbonio, i mesopori degli elettrodi a nanotubi sono interconnessi, permettendo una distribuzione di carica continua che sfrutta quasi tutta l’area della superficie disponibile (Figura 10), anche se i nanotubi hanno un’area modesta se confrontata con quella del carbone attivo.
Siccome gli ioni dell’elettrolita possono diffondere più facilmente nella rete di mesopori, gli elettrodi a nanotubi di carbonio hanno anche una minore ESR rispetto a quella del carbone attivo. L’efficienza della struttura a tappetino intrecciato permette quindi energie specifiche comparabili con gli altri materiali basati sul carbonio e l’ESR ridotta permette potenze specifiche maggiori.
Figura 10: Schema di un nanotubo di carbonio.
Grafene
Il grafene è un materiale bidimensionale avente atomi di carbonio disposti a nido d’ape (Figura 11) il cui piano può essere spesso quanto un singolo atomo, cioè letteralmente un monostrato.

Figura 11 Struttura reticolare a nido d’ape del grafene visibile grazie ad un SEM.
Ottenibile sfogliando la grafite e depositando poi gli strati singoli su di un substrato, il grafene, sintetizzato la prima volta nel 2004 dal gruppo di ricerca del prof. Geim, gode di moltissime proprietà che lo rendono un materiale unico sotto vari aspetti: ha modulo di Young (per sforzi paralleli al piano) pari a quello del diamante; ha una conducibilità maggiore dell’argento e del rame; ha mobilità a temperatura ambiente molto maggiore di quella degli elettroni nel silicio e di altri semiconduttori; è trasparente e flessibile, fabbricabile con pochi difetti e impurezze. Un’altra caratteristica eccezionale del grafene è la sua area di superficie specifica particolarmente ampia, fino a 2675 m2g-1.
L’insieme di queste proprietà lo rendono un materiale di elezione anche per la produzione di SC.
3.2 Soluzioni elettrolitiche
Le soluzioni elettrolitiche rappresentano il 20% delle prestazioni e dei costi di un EDLC (Figura 4) secondo le seguenti ragioni: la tensione applicabile a una cella elettrolitica di un SC, e quindi con essa la possibile densità di energia, dipenderà dalla tensione di rottura dell’elettrolita; la densità di potenza invece, dipendendo dall’ESR della cella, sarà fortemente dipendente dalla conducibilità dell’elettrolita.
Gli elettroliti possono essere acquosi o organici: i primi sono soluzioni acquose aventi per elettrolita un acido (come H2SO4), un idrossido di un metallo alcalino (come KOH) o un sale neutro (come KCl); i secondi sono in genere costituiti da sali quaternari dell’ammonio (come tetraetilammonio tetrafluoroborato o TEATFB) disciolti in solventi organici polari aprotici come l’acetonitrile (ACN) e il propilene carbonato (PC). Gli elettroliti organici sono i più comunemente usati nei dispositivi commerciali grazie alla loro alta tensione di rottura, di solito nel range di 2-2,5 V. Gli elettroliti acquosi hanno invece una minore tensione di rottura, tipicamente di 1 V, ma hanno una conducibilità migliore di quella degli organici.
Nella Figura 12 mostriamo un diagramma di Ragone che mette a confronto i valori delle potenza ed energia specifica per EDLC con soluzioni elettrolitiche acquose e con solvente organico.
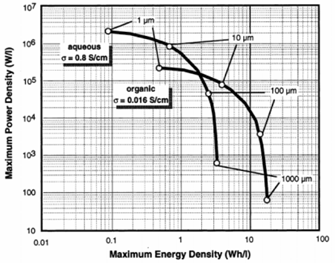
Figura 12: Confronto tra grafici di Ragone per SC che usano elettroliti acquosi e organici [6].
È possibile notare che le soluzioni acquose raggiungono potenze specifiche maggiori ma a parità di potenza danno energie minori, ciò è dovuto principalmente al fatto che è limitata la tensione massima applicabile: dovendo evitare reazioni faradiche, non si può andare che poco oltre 1 V perché altrimenti l’acqua reagisce secondo le seguenti reazioni (elettrolisi dell’acqua):
![]()
quindi al catodo si ha una reazione di riduzione
![]()
mentre all’anodo si ha una reazione di ossidazione
![]()
Gli elettroliti organici, al contrario, riescono a sopportare tensioni operative fino a 2.7-2.8 V prima di incorrere in problemi analoghi. Nel confronto tra elettroliti acquosi ed organici, però, la riduzione in potenza dei secondi rispetto ai primi (a causa della maggiore ESR) è minima ed accettabile, visti i guadagni in termini di energia accumulata. Inoltre, il fatto di utilizzare un solvente organico permette al dispositivo di poter lavorare fino a circa -40°C, mentre con un soluzioni elettrolitiche acquose il limite non va molto al di sotto degli 0°C.
Quindi, per quanto riguarda i prodotti commerciali, si preferisce l’uso di solventi organici e due tra questi, l’acetonitrile e il propilencarbonato, sono considerati i migliori. Entrambi hanno un limite di tensione a 2.8 V, ma il primo consente al SC di operare a temperature inferiori e, più in generale, con resistenze interne più basse. Per quanto riguarda invece la temperatura massima a cui può lavorare una soluzione elettrolitica, le temperature caratteristiche dei solventi (ebollizione, fusione, e flash point) giocano un ruolo cruciale nel range di temperature a cui possono operare, in particolare la sicurezza del SC dipende largamente dal flash point (la minima temperatura a cui un materiale volatile può vaporizzare per formare una miscela infiammabile nell’aria). Nel caso dell’acetonitrile, il range di temperature va da -30°C a 80°C. Attualmente, il TEATFB in acetonitrile è indicato come il miglior soluzione elettrolitica organica per impiego nei SC, raggiungendo valori di conducibilità fino a 60 mScm-1.
Citiamo per completezza la curiosa possibilità presentata dall’Università di Twente in Olanda di un SC dove invece di un elettrolita liquido è stato usato un materiale solido, l’ossido di zirconio reso stabile a temperature ambiente dall’aggiunta di ossido di ittrio. Anche se interessante dal punto di vista scientifico, è però un caso probabilmente sconveniente da quello economico perché l’ossido di zirconio stabilizzato è inserito tra due strati di un composto di tale materiale con il platino, quest’ultimo con una concentrazione che va dal 20% al 55% del volume totale.
3.3 Modelli per il doppio strato
Il termine “doppio strato” venne coniato la prima volta da Helmholtz nel 1853, quando previde due strati di carica all’interfaccia tra due metalli diversi. In seguito, egli confrontò l’interfaccia metallo/metallo con quella metallo/soluzione acquosa. Nel suo modello, l’interfaccia consiste di uno strato di elettroni sulla superficie dell’elettrodo e di uno strato di ioni nell’elettrolita. Nella scienza delle superfici si usa spesso lavorare in termini della capacità differenziale, definita come
![]()
dove σè la densità di carica e V è il potenziale elettrico.
Nei primi anni del 1900, Gouy osservò che la capacità non era una costante ma dipendeva dal potenziale applicato e dalla concentrazione ionica. Gouy propose quindi che l’agitazione termica trattenesse gli ioni dall’accumularsi sulla superficie dell’elettrodo, formando al contrario una carica diffusa nello spazio. La teoria di Gouy si risolve nella seguente capacità differenziale:
![]()
dove z è la valenza degli ioni e k è il reciproco della lunghezza di Debye-Hückel definita dall’equazione

in cui n è il numero di ioni per centimetro cubico, T è la temperatura assoluta e kB è la costante di Boltzmann. La capacità CG risultante dalla distribuzione di carica diffusa non è quindi più una costante. Questo modello oggi è chiamato di Gouy e Chapman perché sviluppato anche da D.C. Chapman. Nel 1924, Stern modificò il modello Gouy-Chapman includendo uno strato compatto così come quello diffusivo di Gouy. Lo strato compatto di Stern consiste di uno strato adsorbito specificamente dagli ioni. Lo strato di Stern venne poi diviso da Grahame in due regioni. Egli denotò la parte degli ioni più simile a quella diffusiva come il piano di Helmholtz esterno (questo è talvolta chiamato il piano di Gouy); lo strato degli ioni adsorbiti sulla superficie dell’elettrodo venne designata come il piano di Helmholtz interno (Figura 13).
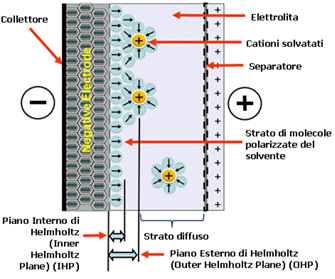
Figura 13: Schema semplificato di un doppio strato di ioni negativi all’elettrodo.
Liquidi ionici
Un’alternativa alle soluzioni elettrolitiche è rappresentata dai liquidi ionici (Room Temperature Ionic Liquid – RTIL o IL), essi sono sali che, come risultato di un impacchettamento cristallino sfavorito (quando per esempio i cationi sono particolarmente grossi rispetto agli anioni e hanno un basso grado di simmetria), sono spesso liquidi a temperatura ambiente e a temperature inferiori. La natura ionica di questi materiali e la debole coordinazione tra gli ioni previene la loro evaporazione, così gli IL non hanno una pressione di vapore misurabile e hanno un’alta stabilità chimica ad alte temperature (anche > 400°C). Il modo in cui si forma il doppio strato con i liquidi ionici è diverso rispetto agli EDLC a causa dell’assenza di un solvente, per cui non vale più il modello di Helmoltz come si può capire osservando la Figura 14.
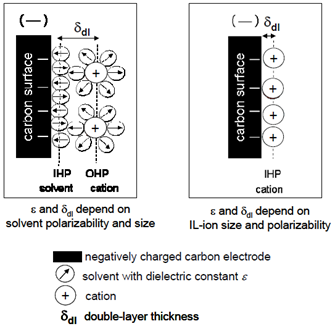
Figura 14: Schema della formazione di un doppio strato all’interfaccia tra car-bonio e un elettrolita convenzionale (a sinistra) e tra carbonio e un liquido ionico (a destra).
Il pregio più importante dei liquidi ionici è l’intervallo di tensione applicabile, che può anche superare i 5 V (superiore quindi a quello degli elettroliti organici convenzionali).
Un buon sostituto dell’acetonitrile è il PYR14TFSI (un sale di pirrolidinio-trifluorometansulfonilimide) per le sue proprietà elettrochimiche, la sua natura idrofobica, il suo alto livello di purezza come richiesto per una lunga durata ciclica e per SC ad alto voltaggio. Un lato negativo è che l’ESR risulta dieci volte maggiore a causa della minore conduttività a 60°C di tale liquido ionico rispetto all’acetonitrile. La resistenza elettrica a temperatura ambiente è quindi ancora tale da non consentire la commercializzazione dei SC a liquidi ionici. Il voltaggio massimo applicabile, inoltre, dipende molto dall’umidità (anche poche ppm di acqua possono abbattere la tensione limite), cosa che comporterebbe notevoli problemi costruttivi per gli impianti di produzione che si dovessero realizzare.
3.4 Altre componenti
Anche se determinano le caratteristiche di un SC in percentuale minore (Figura 4), anche le altre componenti, oltre agli elettrodi e all’elettrolita giocano un ruolo importante. Tutti gli elementi che permettono l’assemblaggio (il separatore, l’uscita e il sistema di contenimento) oltre a influenzare la potenza specifica e l’energia specifica, possono rendere più efficiente il dispositivo tramite una loro ingegnerizzazione intelligente (insieme a quella degli elettrodi) più di quanto possa fare il progettare complicate nanostrutture per i materiali degli elettrodi.
Nel caso dei fogli di alluminio, essi sono necessari da utilizzare come supporto meccanico di un elettrodo perché, di qualsiasi natura siano i materiali attivi, questi si presentano molto spesso in forma di polvere. Un foglio di alluminio ha inoltre la funzione di collettore di corrente perché la conduttività del carbonio è tale da non poterlo impiegare che per elettrodi con spessori non superiori a qualche decina di micron.
Per stabilizzare le polveri carboniose si usano leganti a base polimerica, che aiutano a formare una massa compatta e stabile e aumentano l’aderenza delle polveri al collettore metallico. Si tratta in genere di polimeri inerti, come la carbossimetilcellulosa o il polivinilfluoruro, e di polietilene ad ultra-alto peso molecolare, ma soprattutto di politetrafluoroetilene. Essi devono però essere usati con misura. Se in quantità eccessiva, comporterebbero infatti un aumento della resistenza elettrica (sono isolanti) e una conseguente diminuzione della energia specifica, rappresentando un peso morto ai fini dell’accumulo di energia.
Il separatore di cui abbiamo già parlato all’inizio del paragrafo sugli EDLC, deve essere, come anticipato, chimicamente inerte, perché non possa degradare nel tempo, ed è per questo che, nel caso di elettroliti organici, si fa largo uso di fibre di cellulosa o di tessuti di polipropilene, mentre si usano spesso fibre di vetro nel caso di elettroliti acquosi.
Anche i trasportatori di corrente influenzano la potenza specifica tramite la loro resistenza in serie, per cui si può ottimizzare il loro ruolo riducendo l’alluminio e migliorandone la geometria. Per esempio, la lucidatura dei col-lettori di corrente, il legare chimicamente l’elettrodo ad essi e l’usare sottili pellicole colloidali riducono l’ESR.
4 Pseudo-condensatori
Negli pseudo-condensatori le cariche elettriche sono accumulate principal-mente come risultato di reazioni redox reversibili (pseudo-capacità faraidica). Sono note molte reazioni in cui prendono parte ossidi e solfuri di metalli di transizione come RuO2, IrO2, TiS2 o loro combinazioni. Queste reazioni sono accompagnate da processi di elettro-adsorbimento e di intercalazione: vediamo nel dettaglio i primi due processi citati.
Reazioni redox
Ricordiamo brevemente in cosa consiste una reazione redox. In una reazione di questo tipo sono coinvolti un ossidante (oxidant, da cui -ox) e un riducente (reductant, da cui red. Il potenziale E è dato dall’equazione di Nernst (14):
![]()
dove E0 è il potenziale standard di riduzione, R è la costante universale dei gas, T è la temperatura assoluta, n è il numero di elettroni trasferiti, F è la costante di Faraday e Q è il quozeinte di reazione.
Assorbimento degli ioni
L’accumulo degli ioni per formare uno strato singolo sul substrato dell’elettrodo è un processo reversibile che risulta in un trasferimento di carica faradico e quindi comporta una pseudo-capacità in modo simile a come spiegato nelle reazioni redox.
Nella Figura 15 si può vedere un confronto tra i meccanismi di funzionamento di un EDLC e di uno pseudo-condensatore, in particolare si nota la diversa separazione di carica.
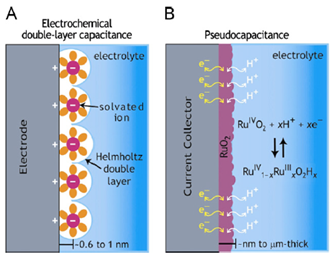
Figura 15: Schema dei meccanismi della conservazione della carica in un (A) EDLC e in un (B) pseudo-condensatore.
L’energia specifica degli pseudo-condensatori è maggiore di quella degli EDLC, tra i 10 e i 50 Wh/L , così come la loro capacità (300-1000 F/g), mentre la loro durata raggiunge centinaia di migliaia di cicli (che è comunque minore di quella degli EDLC). Come abbiamo detto poco fa, quando si pone una d.d.p. agli estremi di uno pseudo-condensatore avvengono più processi; facendo l’esempio di un acido solforico si ha: il caricamento dei doppi strati, le reazioni redox di differenti gruppi sulla superficie, assorbimento chimico dell’idrogeno e l’intercalazione dell’idrogeno. Ciascuno di questi processi può essere rappresentato da uno “scalino” di un modello a scalini con cui lo pseudo-condensatore è descritto tramite un circuito elettrico equivalente del tipo in Figura 16.
Anche gli pseudo-condensatori possono essere realizzati con più tipi di elettrodi, in particolare con polimeri conduttori o con ossidi metallici.
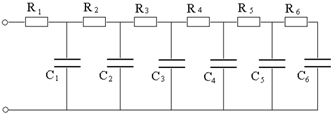
Figura 16: Circuito equivalente di uno pseudo-condensatore.
4.1 Elettrodi
Polimeri conduttori
Uno dei traguardi importanti della moderna elettrochimica è lo sviluppo dei polimeri conduttori. Sappiamo che i polimeri sono degli isolanti, ma si può fare in modo che avvengano reazioni elettrochimiche in sistemi con doppio legame, come polianilina, politiofene e poliacetilene, le quali sono reversibili e possono essere usate nei SC. È possibile rendere un polimero conduttore grazie a processi chiamati doping elettrochimici dei polimeri tramite anioni o cationi (in analogia con i semiconduttori).
I polimeri conduttori hanno una capacità e una conduttività relativamente alta, insieme ad una ESR relativamente bassa e a costi comparabili con i materiali basati sul carbonio. Il loro lato negativo è che presentano limiti nella stabilità dopo molti cicli di carica e scarica; tali limiti vengono spiegati con lo stress meccanico sui polimeri conduttori durante le reazioni di riduzione-ossidazione.
Ossidi metallici
A causa della loro alta conduttività, gli ossidi metallici sono stati studiati come possibili materiali per gli elettrodi degli pseudo-condensatori. La maggioranza delle ricerche rilevanti riguarda l’ossido di rutenio (RuO2), questo perché altri ossidi metallici devono ancora ottenere capacità comparabili. La capacità dell’ossido di rutenio (1358 Fg-1) e la sua buona conducibilità elettrica (3∙102 Scm-1) sono ottenute attraverso l’inserzione e la rimozione o l’intercalazione di protoni nella sua struttura amorfa, secondo la seguente reazione:
![]()
dove 0 ≤ x ≤ 2. Nella sua forma idratata (RuO2∙xH2O), la capacità (720 Fg-1) supera quella dei materiali basati sul carbonio e sui polimeri conduttori. Inoltre, l’ESR dell’ossido di rutenio idratato è minore di quella degli altri materiali per gli elettrodi. Se si usa una disposizione tubulare di strutture porose di RuO2∙xH2O si ha una capacità specifica ancora più alta (1300 Fg-1).
Purtroppo, il successo dell’ossido di rutenio è stato limitato dai suoi costi proibitivi. Un’alternativa più economica può essere rappresentata dall’ossido di manganese (MnO2). Esso ha capacità specifica teorica di 1370 Fg-1, un basso costo e una buona compatibilità ambientale. Il meccanismo di conservazione della carica per gli pseudo-condensatori con MnO2 è basato sull’adsorbimento sulla superficie di cationi (per esempio K+, Na+ o Li+, indicati in generale con C+) così come l’incorporazione di protoni secondo la seguente reazione:
![]()
In ogni caso, la capacità teorica è raggiunta raramente negli esperimenti, principalmente a causa della bassa conducibilità elettrica dell’ossido di manganese (≈10-6 Scm-1) che limita la velocità di lavoro per prestazioni di alta potenza e quindi ostacola le sue applicazioni nei sistemi di accumulo energetico.
Gli elettrodi con ossidi metallici possono essere usati solo con elettroliti acquosi, limitando perciò la tensione applicabile alla cella. I guadagni in densità di potenza dalla minore resistenza spesso sono controbilanciati da perdite dovute proprio alla minore tensione di lavoro. Per riassumere il discorso sugli elettrodi, nella Figura 17 vengono mostrate le capacità specifiche di vari materiali sia per gli EDLC che per gli pseudo-condensatori.
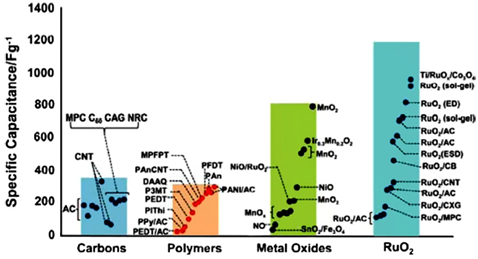
Figura 17 Le prestazioni della capacità sia per EDLC con elettrodi al carbonio sia per elettrodi degli pseudo-condensatori (includendo ossidi metallici di transizione e polimeri conduttori) Copyright 2008, The Electrochemical Society
5 Ibridi
Negli ultimi anni è apparso un nuovo tipo di SC, il sistema ibrido, dove elettrodi a carbonio e faradici sono combinati in modo da incrementare l’energia specifica. Gli elettrodi ibridi non vanno confusi con quelli compositi in cui un tipo di materiale è incorporato in un altro allo stesso elettrodo.
Un motivo del passaggio ad un SC ibrido venne presentato da una ricerca sui polimeri conduttori dell’Università di Bologna, secondo cui non si può realizzare un’alta concentrazione di polimero all’elettrodo negativo, ma si può costruire efficacemente un elettrodo positivo al polimero e quindi realizzare quello negativo con il carbonio attivato. I risultati di tale ricerca sono riassunti nel diagramma di Ragone di Figura 18: i triangoli rappresentano il condensatore ibrido mentre i cerchi quello al carbonio e i valori numerici rappresentano la densità di corrente in mAcm-2 (si notino i miglioramenti in densità di energia del passaggio all’ibrido).
Figura 18 Ragone plot di un supercondensatore ibrido (N) e di uno al carbonio
Un vantaggio dei SC ibridi rispetto ai simmetrici è la loro alta EMAX (perché oltre alla maggiore tensione operativa avviene un raddoppio della capacità, in quanto un solo elettrodo vi contribuisce e non due in serie come nelle comuni celle EDLC) e corrispondentemente la loro maggiore energia specifica (fino a 10-20 Whkg-1, maggiore di quella degli EDLC); anche la potenza specifica è maggiore di quella degli EDLC, anche se resta il problema della ciclabilità limitata a causa della componente faradica. Un vantaggio rispetto alle batterie, invece, è la possibilità del caricamento rapido e della più facile sigillatura ermetica. Attualmente condensatori ibridi del tipo PbO2/H2SO4/AC sono usati nelle sedie a rotelle elettriche e nei bus a motore elettrico.
5.1 Elettrodi
In base alla configurazione degli elettrodi, i SC ibridi si distinguono in compositi, asimmetrici e tipo-batteria.
Compositi
Gli elettrodi compositi integrano materiali basati sul carbonio con polimeri conduttori oppure con ossidi metallici e incorporano meccanismi di immagazzinamento di carica sia fisici sia chimici in un singolo elettrodo. Un caso particolare sono i materiali ibridi nanostrutturati: se si usano per esempio nanotubi di carbonio integrati con polimeri conduttori, l’integrità strutturale dell’intreccio di nanotubi mostra di limitare lo stress meccanico causato dall’inserzione e dalla rimozione degli ioni nei polimeri conduttori. Quindi, a differenza di questi ultimi, gli elettrodi composti sono in grado di raggiungere una stabilità ciclica comparabile con quella degli EDLC.
Si possono ottenere anche strutture ibride ternarie formate contemporanea-mente di carbonio conduttore (per esempio nanotubi di carbonio), ossidi metallici pseudo-capacitivi e di polimeri conduttori. Nella Figura 19 viene mostrato uno schema di materiale ternario costituito di uno scheletro di nanotubi di carbonio, ricoperto di ossido di manganese e poi con un polimero conduttore, il PEDOT-PSS.
Figura 19 Struttura ternaria MnO2/CNTs/PEDOT-PSS (Copyright 2010, American Chemical Society).
I vantaggi chiave dei materiali nanostrutturati includono quindi brevi cammini di trasporto degli elettroni e degli ioni, superfici di area ampia tra l’elettrodo e l’elettrolita e nuove reazioni non possibili nel materiale bulk (in breve la capacità specifica degli ibridi si è riscontrato essere maggiore della somma di quelle dei singoli componenti). I principali svantaggi includono l’aumento di reazioni indesiderate all’interfaccia elettrodo/elettrolita, proprio a causa dell’area maggiore, e sintesi potenzialmente più complesse e aventi costi di fabbricazione maggiori.
Asimmetrici
Gli ibridi asimmetrici combinano processi faradici e non-faradici accoppiando un elettrodo EDLC con uno da pseudo-condensatore. Questi condensatori mitigano il contrasto tra il raggiungimento di una maggiore densità di energia e di potenza rispetto agli EDLC e hanno una stabilità ciclica migliore di quella degli pseudo-condensatori.
Tipo-batteria
Come gli ibridi asimmetrici, gli ibridi tipo-batteria accoppiano due elettrodi differenti, questi ultimi però accoppiano un elettrodo di un SC con quello di una batteria. Le ricerche si sono concentrate principalmente nell’usare idrossido di nichel, diossido di piombo e LTO (Li4Ti5O12) per un elettrodo e carbone attivo per l’altro.
Contrariamente ai risultati promettenti, il parere generale è che saranno necessarie più ricerche per determinare il pieno potenziale degli ibridi tipo-batteria.

